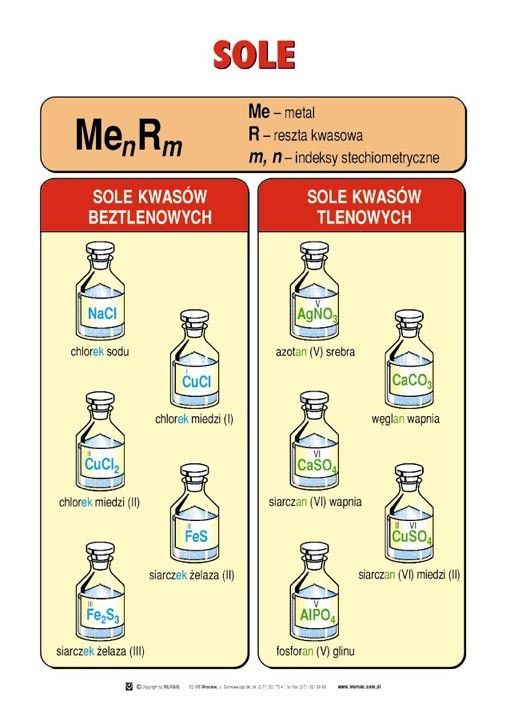
Sole – związki chemiczne, które zawierają kationy metalu(lub aniony amonu)oraz aniony reszty kwasowej.
nazwy soli kw. beztlenowych mają końcówkę –ek, a kw. tlenowych –an.
Dysocjacja jonowa soli – rozpad kryształków soli na kationy metalu i aniony reszt kwasowych pod wpływem cząsteczek wody MmnRnm->mMn++nRm-
Hydroliza soli-reakcja jonów soli z wodą.
Elektrolit mocny prawie w 100% dysocjuje na jony.
Elektrolity mocne to: kwasy solny HCl, siarkowy(VI)H2SO4 , azotowy(V)HNO3, chlorowy(VII)HClO4, wodorotlenki litowców i berylowców bez berylu i magnezu i sole rozpuszczalne w wodzie.
Mocny kwas + mocna zasada-hydroliza nie zachodzi odczyn obojętny.
Słaby kwas+ mocna zasada hydroliza zachodzi hydroliza anionowa odczyn zasadowy.
Mocny kwas+ słaba zasada- hydroliza zachodzi hydroliza kationowa odczyn kwasowy.
Słaby kwas+ słaba zasada- hydroliza zachodzi hydroliza kation-anion odczyn obojętny.
Elektrolit słaby- liczba cząsteczek zdysocjowanych na jony w roztworze jest niewielka.
Elektroliza –całokształt procesów przebiegających na elektrodach pod wpływem prądu stałego.
W zależności od rodzajów substancji poddawanej elektrolizie na elektrodach wydzielają się różne produkty.